21色实验?其实也不难
2018.10.22 点击1982次
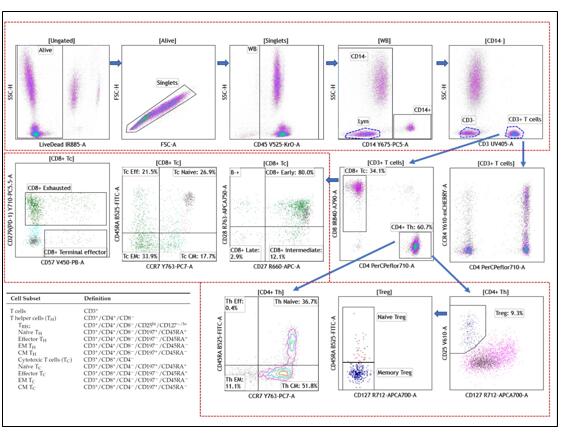
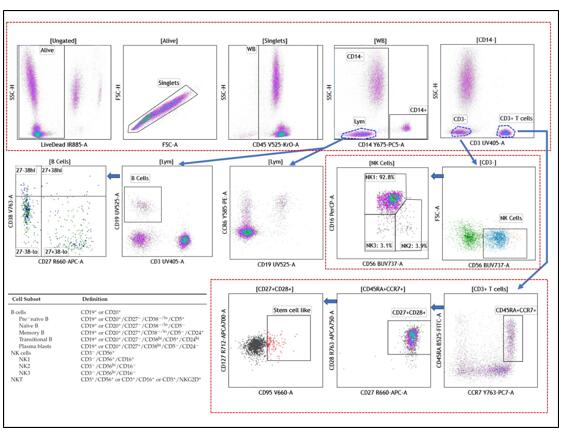
我们知道流式实验中抗体标记的数量越多得到的信息就越详细和准确,以此同时,实验操作也变得更加复杂。多色流式实验中的补偿操作,一直以来都是流式使用者非常关心的问题。甚至有人认为,由于目前荧光染料的光谱普遍比较宽,可能会在相邻的多个通道都造成比较大的干扰,因此很难在流式上完成超过18色以上的实验。事实是否真是这样呢?恰巧哈佛医学院附属麻省总医院的Dr. Ravi Mylvaganam与我们分享了他在6激光21色的CytoFLEX LX上做的一个多色实验。我们一起来看看。 Dr. Ravi Mylvaganam采用20个荧光抗体以及一个细胞死活染料组成21色的panel,可同时检测多群记忆、效应T细胞,调节性T细胞,NK细胞甚至是干细胞样T细胞等细胞亚群,详细的抗体和染料标记如下所示:
实验样本准备步骤: 1. 标记一个样本管,在管中添加3 μL以下抗体: 1) CD3 BUV395 2) CD19 BUV496 3) CD56 BUV737 4) CD25 BV605 5) CD95 BV650 6) CD38 BV786 7) CD16 PerCP 8) CD4 PerCP-eFluor710 9) CCR4 PE-TexasRed 10) CCR7 PC7 11) CD8 AF790 2. 添加25 μL Brilliant Stain Buffer,涡旋混匀4秒;然后加入100 μL全血,再次涡旋混匀4秒后,在37oC下避光孵育20分钟 3. 在试管中添加5 μL以下抗体: 1) CD57 Pacific Blue 2) CD45 Krome Orange 3) CD45 RA FITC 4) CCR6 PE 5) CD14 PC5 6) PD-1 (CD279) PC5.5 7) CD27 APC 8) CD127 APC-A700 9) CD28 APC-A750 4. 涡旋混合试管4秒后室温避光孵育20分钟 5. 在管中添加1 mL VersaLyse裂解液,涡旋混合2~3秒,室温下避光孵育15分钟 6 样本200g离心5分钟,弃去上清液 7. 在试管中添加5 μL IR Fixable染料,涡旋混合2~3秒,室温下避光孵育20分钟 8. 添加2 mL PBS重悬细胞,200g离心处理试管5分钟,弃去上清液 9. 添加0.9 ml PBS和0.1 ml IOTest3固定液重悬细胞,可准备上机检测 10. 同时按照上述的孵育、离心操作制备单染管 实验结果如下
从实验结果图可以看出,这个21色方案的结果分群清晰,不论是常规的CD3+CD4+Th细胞还是含量较低的Treg或者干细胞样T细胞,都能很好的检测到,看来对于CytoFLEX LX而言,21色实验也不是一个难题。如果您需要该方案详细的信息,可与我们联系。 多色补偿问题的简化,与流式细胞仪技术的发展密切相关。遥想小编当年,那个流式细胞仪用完后还要用红布盖起来的年代,我刚开始接触的是一台4色的流式,当时4色实验就是“多色”实验了!那时没有离线补偿也没有自动补偿,流式也没做得那么频繁,调补偿是相当刺激的操作:先在17寸显示屏上画满所有通道两两对应的散点图,上样之后一定要眼疾手快反应迅速默念“横平竖直”,如果相关的门没圈好,或者看到补偿矩阵脑子蒙圈不知道调哪里,一着急就手足无措,经常一管单染管跑完补偿还没调好所以实验前师兄师姐往往要提醒“单染管多准备点样本”…… 现在仪器的补偿操作相比以前,我的天,简直不要好太多! 拿这个做21色方案的CytoFLEX LX举个栗子:
首先,它可以自动调补偿,用户只需要把单染管全跑一遍,圈好相应的阴阳性细胞群,点击计算补偿就OK了,无论是2色还是21色都是这么简单的操作。画一堆图看横平竖直?不存在! 其次,它可以离线调补偿。样本比较多,想测完再拷回去慢慢分析?没问题! 然后,CytoFLEX LX有补偿库功能,只要是做过的染料就可以把这个染料的补偿信息存到库里,以后做实验可以直接读取,避免需要重复做单染管的烦恼。 最后,这个是压轴的技能,方案里调好的补偿会根据后续电压的调整而自动调整。也就是说,以后做完补偿,跑样本时发现某个通道的电压如果再调一点就完美了,如果是以前或其他仪器,您需要调整电压后再重新调补偿,而现在在CytoFLEX LX 上,您直接调电压就好了!
其实很简单, 其实很自然,多色的补偿并没有那么难!虽然补偿的操作更智能化了,但目前多色实验中抗体和染料的选择以及样本的处理仍然是一门学问。如果您需要了解多色实验更多的信息,比如染料的搭配和选择,以及样本处理的方法,您也可以联系贝克曼公司索取资料。 | 产品分类
|
 |