聚焦Tau蛋白修饰:揭开神经退行性疾病热门靶点的神秘面纱
作者:义翘神州 2025.02.26 点击787次
前言在神经退行性疾病的研究领域,阿尔茨海默病(AD)犹如一场无声的风暴,逐渐吞噬者的记忆与思维。在我们不断挖掘这一疾病病理机制的过程中,那些曾经看起来遥不可及的治-疗靶点又有怎样的进展呢? 现在,我们就一起走进AD研究的前沿阵地,了解Tau靶向治-疗的新进展吧!
Tau蛋白概述研究已经证实,在AD患-者中,Tau蛋白可能发生多种异常的翻译后修饰(PTMs),如磷酸化、泛素化、乙酰化、截断等。异常的PTMs造成Tau蛋白在细胞内的错误定位和异常聚集,导致线粒体功能障碍、突触可塑性受损、神经胶质增生和神经炎症,最终引发神经退行性病变和认知功能障碍。 Tau蛋白在AD以外的多种神经退行性疾病中存在,如行性核上性麻痹(PSP)、皮质基底节变性(CBD)、匹克病、额颞叶痴呆(FTD)和原发性年龄相关性tau病。这使Tau蛋白成为神经退行性疾病治-疗的一个强有力的靶点。 Tau靶向疗法正在如火如荼地开展,多种策略齐头并进。如以降低Tau表达为目的的反义核苷酸,靶向Tau蛋白修饰的磷酸酶激活剂、激酶抑制剂、乙酰化抑制剂等,以及创新性的免疫疗法(如疫苗、抗体、抗体片段、PROTAC等)。
SignalChem Biotech(义翘神州全资子公司)建立了产品齐全的重组Tau蛋白库,涵盖多种异构体和磷酸化蛋白,已成为开发诊断检测、探索靶向治-疗和推进药物开发的重要工具。
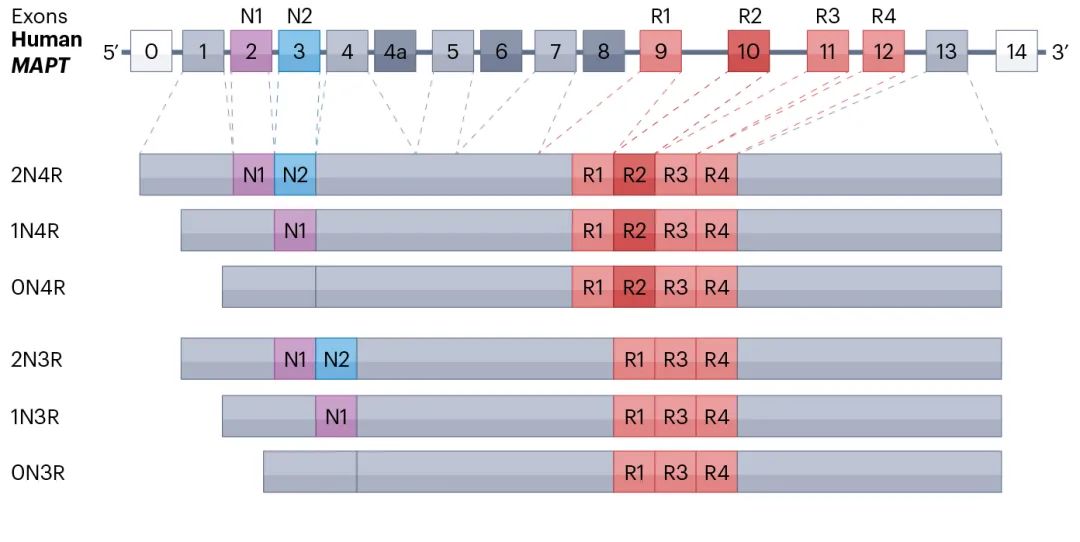
Tau蛋白:结构与功能的精妙之处Tau蛋白在1975年被发现,主要分布在中枢神经系统的神经元轴突中,促进微管的组装并稳定微管网络。在少突胶质细胞和星形胶质细胞中存在较低浓度的Tau蛋白。 Tau蛋白由17号染色体(17q21-q22)上的MAPT基因编码,包含16个外显子。蛋白结构包括N端结构域、富含脯氨酸结构域、微管结合结构域和C端结构域。 Tau蛋白在成人大脑中存在6种异构体:0N4R、1N4R、2N4R、0N3R、1N3R、2N3R。外显子2和3的选择性剪接导致Tau蛋白的N端差异,外显子10导致Tau蛋白含3个或4个微管结合重复结构域(4R或3R)。健康成人大脑中的3R与4R比例接近1:1,在原发性Tau蛋白病中,外显子10的选择性剪接造成3R与4R比例改变。
Tau蛋白的剪接与异构体(源自文献:doi: 10.1038/s41580-024-00753-9)
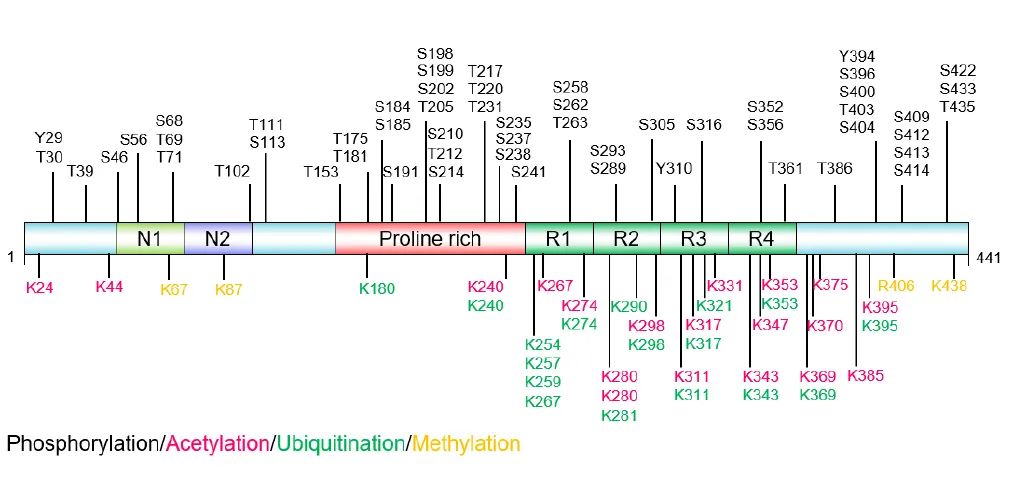
Tau蛋白在神经元细胞骨架中具有重要作用。神经元细胞骨架由微丝、微管和中间丝组成,微管负责维持神经元的形态及物质运输。Tau蛋白是一种微管相关蛋白,在轴突中与微管结合,促进微管的组装并防止其降解。 Tau蛋白的功能受到多种翻译后修饰的精细调控。据统计人类Tau蛋白经历了95种类型的PTMs,如泛素化、磷酸化、硝化、截断、乙酰化、甲基化、O-GlcNAcylation、糖化、糖基化、SUMO化、异构化等。
Tau蛋白翻译后修饰的主要位点(源自文献:doi: 10.4103/1673-5374.385847)
其中磷酸化、乙酰化和糖基化,在生理和病理条件下都会发生。磷酸化受多种激酶和磷酸酶调控,不同位点的磷酸化对Tau功能影响各异。乙酰化主要发生在富含脯氨酸结构域和微管结合结构域,影响Tau的降解和聚集。泛素化一般促进Tau降解,但也可能增加其聚集。SUMO化抑制Tau降解并促进其磷酸化。截断产生的片段能增强Tau聚集和神经毒性。其他翻译后修饰也在Tau病理过程中发挥作用。
Tau翻译后修饰与病理机制 1. Tau磷酸化 Tau蛋白的PTMs研究较为广泛深入的是磷酸化。生理过程中,磷酸化调节Tau对微管的亲和力,调控其组装和稳定性。Tau蛋白磷酸化受发育阶段调节。胚胎和发育早期Tau磷酸化显著高于成年人,但老年大脑中Tau蛋白的磷酸化与胚胎期接近。 最长的Tau亚型(2N4R,Tau-441)大约有80个潜在的丝氨酸和苏氨酸磷酸化位点,上图中标注了在AD中发现的近40个磷酸化位点。 多种蛋白激酶调节Tau蛋白磷酸化。根据激酶基序可以分为3组:脯氨酸导向蛋白激酶(PDPKs)、非脯氨酸导向的蛋白激酶(non-PDPKs)、酪氨酸蛋白激酶(TKs)。研究发现,AD患-者大脑中GSK-3β、CDK5、DYRK1A、CK1、CK2、p38 MAPK、Fyn等激酶表达量升高,GSK-3β、CDK5和病理性Tau共定位。AD患-者中GSK-3β和CDK5可以从多个位点磷酸化Tau,如Ser202、Thr212、Ser214等。在小鼠模型中,抑制CDK5、下调GSK-3β活性或使用GSK-3β抑制剂,能够降低Tau磷酸化。
Tau蛋白磷酸化受蛋白激酶和磷酸酶动态调节。磷酸酶PP1、PP2A、PP2B、PP2C和PP5使Tau去磷酸化。人脑中与Tau相关的磷酸酶活性,约70%由PP2A调节。在AD患-者大脑中,灰质和白质中的PP2A活性分别下降20%和40%。 PP2A失活涉及多种机制,如PP2A催化结构的PTMs、催化/调节亚基的mRNA和蛋白质表达降低,以及内源性PP2A抑制剂水平升高。常见的PP2A抑制剂有I1PP2A、I2PP2A和CIP2A。研究表明,抑制PP2A导致Tau蛋白过度磷酸化以及引发记忆缺陷,而沉默I2PP2A或抑制CIP2A,能够减少Tau蛋白过度磷酸化并改善记忆缺陷。在原代神经元中过表达CIP2A导致Tau蛋白在神经元树突中的错误定位和突触退化。GSK-3β和PP2A之间存在相互作用。 虽然Tau蛋白的过度磷酸化是AD和其它神经退行性疾病的标志性病理,但Tau的具体磷酸化位点可能在其生理和病理机制中具有相反的作用。如GSK-3β和CDK5介导的Ser202、Thr231位点的磷酸化,促进Tau聚集、神经原纤维缠结(NFTs)形成和突出损伤,但p38 MAPK介导的Thr205位点的磷酸化能防止β-淀粉样蛋白诱导的早期AD细胞死亡、神经元回路畸变和记忆缺陷。这些研究表明,不同的Tau磷酸化位点在Tau病理和认知功能障碍中具有不同的作用。因此,靶向Tau磷酸化时选择合适的抗原表位,有助于提供靶向药物的安全性和有效性。
2. Tau乙酰化 Tau乙酰化主要发生在富含脯氨酸结构域和微管结合结构域。P300乙酰转移酶(HAT)和环磷酸腺苷反应元件结合蛋白(CREB)被鉴定为Tau乙酰转移酶。乙酰化具有残基特异性,如Lys163、Lys281、Lys274、Lys280、Lys174和Lys369的乙酰化防止Tau降解,Lys259、Lys290、Lys321和Lys353的乙酰化抑制Tau磷酸化并阻止其聚集。sirtuin1(SIRT1)和组蛋白脱乙酰酶6(HDAC6)使Tau蛋白去乙酰化。抑制SIRT1的表达或HDAC6表达缺失会加速Tau病理和认知能力下降。在接受双水杨酯(Salsalate)或氟苯水杨酸(Diflunisal)等p300抑制剂的患-者中,创伤性脑损伤和AD的发生率降低。因此,靶向Tau乙酰化是治-疗人类Tau蛋白病的新型治-疗方法。
3. Tau泛素化 泛素化是将一个或多个泛素转移到赖氨酸残基的三步酶促过程,由泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)参与。441-Tau蛋白的富含脯氨酸结构域和微管结合结构域含有20多个泛素化位点。泛素化通过泛素-蛋白酶体系促进Tau降解。在CHIP敲除小鼠中观察到非聚集的、泛素阴性、过度磷酸化的Tau积累。TRAF6介导的Lys63多泛素化增强蛋白酶体靶向Tau的清除率。泛素化抑制Tau介导的微管组装。USP10、USP11、USP13等去泛素酶,增加Tau聚集。因此靶向Tau泛素化是AD患-者潜在的治-疗策略。
4. Tau SUMO化 SUMO化是将SUMO蛋白共价连接到靶蛋白特异性赖氨酸残基上的过程。在哺乳动物大脑中表达3种SUMO蛋白:SUMO1、SUMO2、SUMO3,其中SUMO1优先SUMO化Tau蛋白。在AD患-者大脑中,SUMO化与泛素化竞争抑制Tau蛋白的降解。
5. Tau截断 在多种Tau蛋白病中观察到Tau截断,说明其在Tau聚集和神经退化中具有至关重要的作用。截断的Tau蛋白,如Tau1-314、Tau1-368和Tau1-421,在树突中显示出聚集增强、定位错误。半胱氨酸蛋白酶(caspase 6和3)在Asp13和Asp421位点切割Tau。Caspase2在Asp314处截断Tau,导致可逆的记忆缺陷。钙蛋白酶介导的Tau裂解具有神经毒性。天冬酰胺内肽酶(Legumain)在N255和N368处截断Tau,损害微管组装和轴突伸长,同时促进Tau过度磷酸化。
6. Tau的其它PTMs Tau存在甲基化、糖基化、O-GlcNAc、异构化等翻译后修饰。 甲基化促进Tau蛋白间的相互作用,抑制Tau聚集。N-糖基化促进Tau的过度磷酸化,O-糖基化反而防止Tau磷酸化和积累。Tau异构化促进脯氨酸残基重排。Pin1是一种肽基-脯氨酰顺式/反式异构酶,特异性异构化磷酸化的Thr-Pro键。在AD和脑损伤患-者中存在顺式Tau,导致Tau过度磷酸化和神经退化,而反式Tau更容易去磷酸化。 各种PTMs之间存在多种相关性。如去除泛素可以在Lys281发生乙酰化,高水平的SUMO化抑制Tau的泛素化和降解。不同位点的乙酰化以不同的方式调节Tau的磷酸化,如K280位点的乙酰化增加Tau在Ser199/202、Thr231、Ser202/Thr205和Ser422位点的磷酸化。 Tau蛋白:靶向治-疗的关键靶点当Tau蛋白发生高度磷酸化、异常糖基化、异常泛素化等PTMs时,形成神经纤维缠结,导致神经细胞死亡,驱动多种神经退行性疾病发生。复杂多样的翻译后修饰为靶向Tau治-疗提供多种靶点。对Tau蛋白的表达、翻译后修饰、聚集和降解等过程进行干预,为神经退行性疾病的治-疗提供潜在靶点和思路。
Tau相关治-疗靶点(源自文献:doi: 10.1038/s41582-023-00883-2)
Tau表达抑制剂和聚集抑制剂,可以抑制Tau蛋白的产生,减少有害聚集体的形成。通过调控细胞自噬或蛋白酶体系统,促进异常Tau蛋白降解。利用免疫系统的主动或被动识别并清除异常Tau蛋白。微管稳定剂能够校正因Tau蛋白异常导致的微管损伤。 靶向Tau蛋白修饰的治-疗策略有磷酸酶调节剂、激酶抑制剂、乙酰化抑制剂、去糖基化抑制剂和半胱天冬酶抑制剂等。Caspase抑制剂阻止Tau蛋白被半胱天冬酶切割,避免产生过多具有神经毒性的Tau截断。OGA抑制剂调节Tau蛋白的O-GlcNAc糖基化修饰。激酶抑制剂和磷酸酶激活剂,动态平衡Tau的磷酸化和去磷酸化。乙酰化抑制剂调节Tau蛋白的活性和稳定性。 除此之外,Tau免疫疗法研究也在如火如荼的进行中。氨基末端、中间结构域、微管结合区、错误折叠的Tau、p-Tau202、p-Tau231、p-Tau396/404、p-Tau409、p-Tau413、p-Tau422和寡聚Tau蛋白等可能是Tau抗原表位的有效靶点。抗体、疫苗、抗体片段、PROTACs等传统和新型免疫技术正在用于Tau蛋白病的治-疗开发中。 也许,靶向Tau疗法的进展不会像大家希望的那样迅速,但是Tau的胞内定位、大小和复杂性使其成为比Aβ更具挑战性的靶点。未来的研究将进一步揭示Tau蛋白的功能机制及其在疾病中的具体作用,为相关疾病的诊断和治-疗提供新的思路和方法。
Tau靶向疗法的优缺点 1药物类型:反义寡核苷酸(Antisense oligonucleotides) 优势: ①降低总Tau水平,使聚集体解离,减少减轻病症 ②特异性靶向Tau ③在人体试验中安全且耐受性良好 ④降低人脑脊液(CSF)中Tau水平至基线以下 劣势: ①降低非病理性Tau水平,可能会产生未知的后果 ②在某些动物模型中,Tau敲除或敲低会导致认知和运动缺陷
2药物类型:磷酸酶激活剂(Phosphatase activators) 优势: ①Tau去磷酸化,增加Tau与微管结合,降低Tau聚集 ②PP2A负责大部分Tau蛋白的去磷酸化 劣势: ①PP2A还参与代谢、基因表达、信号转导、凋亡和细胞周期等过程,全身性抑制PP2A可能有脱靶效应 ②在轻中度AD患-者中,抑制PP2A不会降低CSF中的AD生物标志物水平
3药物类型:激酶抑制剂(Kinase inhibitors) 优势: ①减少磷酸化,增加Tau与微管结合,降低Tau聚集 ②激酶抑制剂锂(Lithium)已被批准用于人体,且广泛用于其他病症 劣势: ①靶向的激酶参与其他信号通路,如GSK3β影响代谢、自噬、DNA修复和细胞凋亡,全面抑制可能会有脱靶效应 ②长期使用锂有严重不良反应 ③低剂量锂对GSK3β活性无影响
4药物类型:乙酰化抑制剂(Acetylation inhibitors) 优势: ①减少乙酰化,增加Tau与微管结合,调节磷酸化并促进Tau裂解,不易聚集 ②双水杨酸酯可减少乙酰化和总Tau水平,防止小鼠模型的海马萎缩并改善其记忆 ③在人体试验中安全且耐受性良好 劣势: ①抑制乙酰化会影响多种分子,存在未知结果 ②双水杨酸酯不能改善人体认知能力和降低CSF中AD生物标志物水平 ③双水杨酸酯并非Tau特异性
5药物类型:去糖基化抑制剂(Deglycosylation inhibitors) 优势: ①O-GlcNAc糖基化具有保护作用,可防止Tau磷酸化和聚集 ②OGA抑制剂在临床试验中显示出良好的脑渗透性和安全性 劣势: ①不仅靶向tau蛋白,还影响代谢和信号功能 ②O-GlcNAc糖基化与其他蛋白质的生物学相关性未知
6药物类型:半胱天冬酶抑制剂(Caspase inhibitors) 优势:阻断Tau截断,促进其与微管结合,抑制Tau蛋白聚集和毒性,并改善突触和细胞器的功能 劣势: ①半胱天冬酶不只切割Tau,还参与细胞因子激活和细胞凋亡 ②米诺环素会产生不良反应
7药物类型:Tau蛋白聚集抑制剂(Tau aggregation inhibitors)优势: ①减少Tau聚集,降低其毒性 ②比抗体更容易生产 ③用于修饰Tau结合和脑摄取 劣势: ①体外有效的抑制剂通常在体内表现出毒性或缺乏血脑屏障通透性②通常与各种蛋白质中的β折叠结合 ③某些情况下,Tau聚焦可能是一种防御机制,防止较小聚集体的毒性
8药物类型:微管稳定剂(Microtubule stabilizers) 优势:可改善轴突运输,并支持神经元突起和树突棘的维持 劣势: ①治-疗窗口窄且在人体中存在显著毒性 ②TPI-287在人体测试中耐受性差,且显示会使痴呆症状恶化,无法证实其脑渗透性
9药物类型:主动免疫疗法(Active immunotherapy) 优势: ①特异性靶向Tau蛋白 ②主动免疫疗法比被动免疫疗法更具成本效益且持续时间更长 ③在患-者中诱导多克隆反应可能会进一步提高疗效 劣势: ①可能出现不可逆的不良免疫反应 ②产生的抗体可能无法靶向最佳表位
10药物类型:被动免疫疗法(Passive immunotherapy) 优势: ①特异性靶向Tau蛋白 ②抗体可设计为靶向特定病理表位,根据疾病阶段治-疗 ③抗体或抗体片段可进一步修饰以增强清除 ④如果停止治-疗,抗体将被清除,因此不良反应可能是可逆的 劣势: ①可能出现不良免疫反应 ②表位的选择很重要 ③最佳疗效需要细胞外和细胞内清除 ④人源化可能会改变抗体特性
SignalChem Biotech重组Tau蛋白库SignalChem Biotech(义翘神州全资子公司)重组Tau蛋白库,涵盖多种异构体和磷酸化蛋白,可用于开发检测磷酸化Tau217等生物标志物的方法、研究Tau修饰对神经元功能和损伤的机制,已助力多篇文献发表在顶级期刊。高质量的重组Tau蛋白已成为开发诊断检测、探索靶向治-疗和推进药物开发的重要工具。
免责声明:义翘神州内容团队仅是分享和解读公开的研究论文及其发现,专注于介绍全球生物医药研究新进展。本文仅作信息交流用,文中观点不代表义翘神州立场。随着对疾病机制研究的深入,新的实验结果或结论可能会修改或推翻文中的描述,还请大家理解。 本文不属于治-疗方案推荐,如需获得治-疗方案指导,请前往正规医院就诊。本司产品目前仅可用于科学研究,不可用于临床治-疗。 【参考文献】 1. Parra Bravo, C., Naguib, S.A. & Gan, L. Cellular and pathological functions of tau. Nat Rev Mol Cell Biol 25, 845–864 (2024). https://doi.org/10.1038/s41580-024-00753-9 2. Jinwang Ye, et al. Targeting tau in Alzheimer's disease: from mechanisms to clinical therapy. Neural Regen Res. 2024 Jul 1;19(7):1489-1498.doi: 10.4103/1673-5374.385847 3. Congdon, E.E. et al. Tau-targeting therapies for Alzheimer disease: current status and future directions. Nat Rev Neurol 19, 715–736 (2023). https://doi.org/10.1038/s41582-023-00883-2
本文来自:义翘神州微信公众号 | 产品分类
|
 |